Строение белков. структуры белков
Содержание:
- Введение
- Типы третичных структур
- Определение третичной структуры
- Классификация белков
- Что такое вторичная структура белка
- Какова первичная структура белка
- Уровни организации белков
- Функции белков
- 6.Структуры белка – биохимия
- Вторичная структура РНК
- Свойства белков
- Экспериментальное определение
- Третичная структура взаимодействия
- Структуры белков
Введение
Для функционирования белков крайне важна как их аминокислотного (пептидная) последовательность, так и трехмерная структура, которая формируется в процессе свертывания (англ. Folding).
Трехмерная структура белков с нормальными природными условиями называется нативным состоянию белка. Обычно структура белков делится на четыре уровня:
- Первичная структура — последовательность аминокислот в пептидной цепи.
- Вторичная структура — регулярные под-структуры (например альфа-спирали и бета-листы), которые определяются локально, таким образом что в одной молекуле белка обычно существует много подобных структурных элементов (мотивов).
- Третичная структура — трехмерная структура единой белковой молекулы, пространственное расположение вторичных структур.
- Четвертичная структура — комплекс из нескольких молекул белка или полипептидных цепочек, который обычно называют белком в этом контексте, функционирующих вместе в составе белкового комплекса.
В дополнение к этим уровням структуры, белок может изменяться между несколькими подобными структурами в процессе осуществления своей биологической функции. В контексте этих функциональных перестановок, эти третичные или четвертные структуры обычно называются конформациями, а переходы между ними — конформационными изменениями.
Первичная структура удерживается с помощью пептидных связей типа ковалентных связей, образующихся в процессе стадии трансляции биосинтеза белков. Эти пептидные связи обеспечивают жесткость белка. Два конца аминокислотного цепочки называются C-концом или карбоксильным концом и N-конец или амино концов, заснувуючись природе свободной группы на каждом конце.
Различные виды вторичной структуры возникают локально между аминокислотами полипептидной цепочки и стабилизируются водородными связями. Однако, эти водородные связи в целом недостаточно устойчивы самостоятельно, потому что водородная связь с молекулами воды обычно благоприятный, чем водородная связь между амидными группами. Поэтому вторичная структура устойчива только когда локальная концентрация воды достаточно низкая, например, в пределах глобулы или в полностью свернутом белка.
Так же как и вторичная структура, образование глобул и третичной структуры стабилизируется преимущественно структурно неспецифическими взаимодействиями, например сродством аминокислот и гидрофобными взаимодействиями. Однако, третичная структура стабилизируется только когда некоторые части белка закреплены структурно специфическими взаимодействиями, например ионными связями (солевыми мостиками), водородными связями и стеричною упаковкой боковых цепочек. Третичная структура внеклеточных белков может также стабилизироваться дисульфидными связями, которые сокращают энтропию развернутого состояния. Дисульфидные связи чрезвычайно редки в цитоплазмених белках, потому что цитозоль обычно восстанавливающим окружением.
Типы третичных структур
Глобулярные белки
Большинство белков попадают в эту категорию. Глобулярные белки образуют компактную шариковидную форму, где гидрофобные аминокислоты находятся в центре структуры, а гидрофильные аминокислоты находятся на поверхности, образуя молекулу, которая растворима в воде. Многие глобулярные белки имеют домены, которые являются локально свернутыми частями третичной структуры, в пределах от 50 аминокислот до 350 аминокислот. Один домен может быть найдено более чем в одном белке, если белки имеют сходные функции, а белок с множественными функциями может иметь более одного домена, каждый из которых играет определенную роль. Примером глобулярных белков являются ферменты, найденные в наших клетках.
Волокнистые белки
Волокнистые белки состоят из волокон, часто состоящих из повторяющихся последовательностей аминокислот, в результате чего получается высокоупорядоченная удлиненная молекула. Они включают хрящ, который обеспечивает структурную поддержку и нерастворим в воде.
- кофактор – Важный небелковый компонент в ферментах, который активирует их или играет роль в химических реакциях.
- изомер – Соединения с различным расположением атомов, но одинаковыми химическая формула,
- лиганд – вещество, такое как гормон, который связывается с определенной биомолекулой, чтобы служить цели.
- Четвертичная структура – Формируется, когда несколько белковых субъединиц объединяются в комплекс.
Определение третичной структуры
Третичная структура – это структура, при которой полипептидные цепи становятся функциональными. На этом уровне каждый белок имеет определенную трехмерную форму и представляет функциональные группы на своей внешней поверхности, позволяя ему взаимодействовать с другими молекулами и придавая ему уникальную функцию. Договоренность сделана с помощью шаперонов, которые перемещают цепочку белка, сближая различные группы в цепочке, чтобы помочь им сформировать связи. Эти аминокислоты взаимодействующие обычно находятся далеко друг от друга в цепочке.
Первичная структура белка, представляющая собой простую цепочку аминокислот, удерживаемую вместе пептидными связями, определяет структуры высшего или вторичного или третичного порядка, определяя складывание цепи. Каждая аминокислота имеет уникальную боковую цепь или R-группу, что придает аминокислотам их отличные свойства.
Когда белок, такой как фермент, теряет свою третичную структуру, он больше не может выполнять свою работу, потому что он стал денатурированным и потерял свою биологическую функцию. Это обычно происходит при температурах, которые слишком высоки для белка молекула, Однако, как только температура возвращается к нормальной, третичная структура может быть достигнута снова
Это говорит о том, что именно первичная структура является наиболее важной для определения более сложного складывания
Классификация белков
Белки делятся по своему внутреннему строению:
- Фибриллярные — в строении преобладает вторичная структура. Нерастворимы в воде, обладают высокой механической прочностью. Состоят из длинных полипептидных цепочек и имеют бета-слой. Входят в состав соединительной ткани (сухожилия, костная ткань). Таковыми являются коллаген, фиброин, керотин.
- Глобулярные — в строении преобладает третичная структура. Растворимы в воде, образуют коллоиды. Выполняют ферментативную, защитную (антитела), гормональную (инсулин, глюкагон) функции. Также благодаря им вода удерживается в цитоплазме.
- Промежуточные — имеют фибриллярную структуру. Во всех моментах схожи с фибриллярными белками, но имеют одно различие — растворимость в воде.
Белки подразделяются и по сложности строения:
- Простые — состоят только из аминокислот. Таковыми являются альбумины (в крови и яичном белке) и глобулины (в крови).
- Сложные — в строении, помимо аминокислот, имеют простетическую часть. Приведем примеры сложных белков: казеин молока, муцин (в слюне), нуклеопротеины (их образуют хромосомы), липопротеины, хромопротеины (состоят из железа и гемоглобина).
Мы разобрали все самые важные моменты строения белковых молекул. Нужно остановиться на последнем вопросе — функциях белков.
Рис. 6. Функции белков
Что такое вторичная структура белка
Вторичная структура белка представляет собой α-спираль или β-слой, образованный из его первичной структуры. Это полностью зависит от образования водородных связей между структурными компонентами аминокислот. Как α-спираль, так и β-лист содержат регулярные повторяющиеся паттерны в позвоночнике.
альфа-спираль
Намотка полипептидного остова вокруг воображаемой оси по часовой стрелке образует α-спираль. Это происходит через образование водородных связей между атомом кислорода в карбонильной группе (C = O) аминокислоты и атомом водорода в аминогруппе (NH) четвертой аминокислоты полипептидной цепи.
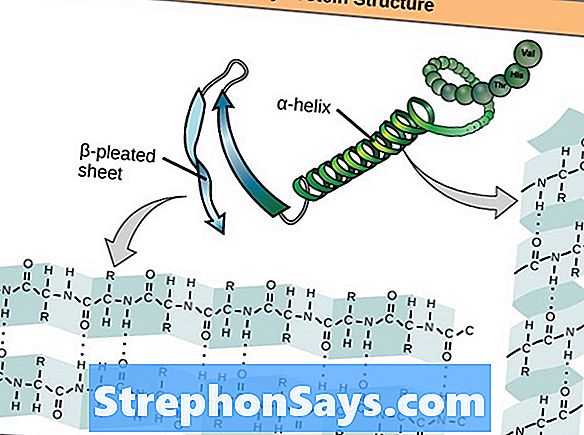
Рисунок 2: Альфа-спираль и бета-лист
β-лист
В β-листе R-группа каждой аминокислоты альтернативно указывает выше и ниже основной цепи. Образование водородной связи происходит между соседними нитями, которые лежат рядом. Это означает, что атом кислорода карбонильной группы одной цепи образует водородную связь с атомом водорода аминогруппы второй цепи. Расположение двух нитей может быть параллельным или антипараллельным. Противопараллельные пряди более устойчивы.
Какова первичная структура белка
Первичной структурой белка является аминокислотная последовательность белка, которая является линейной. Он образует полипептидную цепь белка. Каждая аминокислота связывается с соседней аминокислотой через пептидную связь. Из-за ряда пептидных связей в аминокислотной последовательности она называется полипептидной цепью. Аминокислоты в полипептидной цепи входят в число 20 незаменимых аминокислот.

Рисунок 1: Линейная аминокислотная последовательность
Последовательность кодонов белка, кодирующего ген, определяет порядок аминокислот в полипептидной цепи. Кодирующая последовательность сначала транскрибируется в мРНК, а затем декодируется для образования аминокислотной последовательности.Первым процессом является транскрипция, которая происходит внутри ядра. РНК-полимераза — это фермент, участвующий в транскрипции. Последний процесс представляет собой трансляцию, которая происходит в цитоплазме. Рибосомы — это органеллы, которые облегчают перевод.
Уровни организации белков
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
Первичная структура белка — определенная последовательность a-аминокислотных остатков в полипептидной цепи.
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве.
Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).
Вторичная структура белка — конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О.
В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль.
Существует два основных способа укладки цепи.
Одна из моделей вторичной структуры — a-спираль. Другая модель – β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи.
В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями.
Большинство белков содержит как α-спирали, так и β-структуры.
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S- , водородных связей, гидрофобных и ионных взаимодействий.
Третичная структура – это трехмерная пространственная конфигурация закрученной α-спирали или β-структуры в пространстве.
У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу».
Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие — от греч. гидро – вода, фобос – страх) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи.
В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп (солевые мостики) NH3+ и COO— .
Интересно знать!
В составе волос содержится белок кератин. В его молекуле имеется большое количество дисульфидных связей. С помощью химической завивки волосам можно придать другую форму. Для этого волосы сначала накручивают на бигуди, затем обрабатывают раствором реагента-восстановителя, разрушающего дисульфидные связи, и прогревают. В результате этого кератин приобретает иную пространственную структуру. Далее волосы промывают и обрабатывают реагентом-окислителем, при этом происходит образование новых дисульфидных связей. Вследствие этого вновь приобретенная структура кератина стабилизируется. Волосы приобретают другую форму.
Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами.
Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом.
Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α- и β-цепей и гема.
Гемоглобин — сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет.
В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода.
Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.
Рубрики: Белки
Функции белков
Строение белков, все четыре структуры этих полимеров, обусловливают их функции. Каждый определенный белок выполняет и свою функцию, и общие задачи для этого класса веществ:
- Структурная — главнейшая задача данных полимеров. Данную функцию белки выполняют на различных уровнях организации живой материи. Но главным является то, что они входят в состав всех клеточных мембран. Отдельные представители — коллаген, эластин, керотин содержатся в перьях, волосах, коже и ногтях.
- Транспортная — не менее важная задача белков. Гемоглобин переносит кислород и углекислый газ в крови позвоночных. Гемоцианин выполняет аналогичные действия, но у беспозвоночных. Миоглобин транспортирует кислород к мышцам.
- Защитная — осуществление защиты от различных инфекций и вредоносных микроорганизмов. Выполняют эту задачу антитела крови, фибриноген, тромбин, способствующие процессам свертывания крови и образования тромбов. Каталаза препятствует развитию свободно-радикальных процессов, которые являются крайне вредоносными для человеческого организма.
- Ферментативная — белки катализируют практически все химические реакции, происходящие в клетке. Функцию выполняют трипсин и глутамин-синтетаза.
- Сократительная — актин и миозин участвуют в сокращении мышц.
- Регуляторная — количество определенных веществ регулируют инсулин, глюкагон и специальное сложное вещество — адренокортикотропин (АКТГ).
- Запасающая — питательные вещества запасают казеин молока, яичный альбумин.
- Токсичная — данную задачу выполняют особые белки-токсины, каковыми являются змеиный и дифтерийный яды.
- Энергетическая — самая незначительная и маловажная. За счет расщепления одного грамма белка выделяется 17,6 килоджоулей энергии.
Итак, разобрав строение белков, мы узнали, что они являются непериодическими биополимерами, состоящими из 20 аминокислот. Различные представители этого класса веществ могут иметь от одной до четырех структур, в каждой из которых преобладают свои виды связи. Белки, различающиеся по своей форме и количеству структур, имеют индивидуальные физические свойства и отдельные функции. Незаменимость белков для всех живых существ мы доказали при рассмотрении выполняемых ими задач.Для закрепления изученного материала рекомендуем пройти тест, расположенный ниже, и посмотреть видео.
6.Структуры белка – биохимия
Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген. Один виток спирали α-цепи содержит три аминокислотных остатка.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана.
Коллаген существует в нескольких формах. Основная структура всех типов коллагена является схожей.
Тропоколлаген (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определенное расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга.
Внутри существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы).
Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala)n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями.
Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен.
Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Фиброин может образовывать три типа структур, называемых шёлк I, II и III. Шёлк I – натуральная форма фиброина, который выделяется из шёлкоотделительных желез тутового шелкопряда и присутствует в шелке-сырце. Шёлк II – структура фиброиновых молекул в крученой шёлковой пряже, его прочность выше, и он часто используется коммерчески в различных областях.
Шёлк III – недавно открытая структура фиброина, впервые замеченная профессором Региной Валуцци (Regina Valluzzi) с помощниками в Тафтском Уиниверситете. Шёлк III формируется преимущественно в растворах фиброинов на поверхности раздела (то есть границе между водой и воздухом, поверхность раздела вода-нефть и т.д.).
Исследование шёлка III для лучшего понимания его физической структуры, качеств и состава продолжается.
Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи – такие структуры, как волосы,ногти, рога носорогов, перья и рамфотека клюва птиц и др.
Согласно новой номенклатуре кератинов, в это семейство входят также цитокератины, образующие наиболее прочные элементы внутриклеточного цитоскелета эпителиальных клеток.
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
- α-кератины имеют конформацию в виде плотных витков вокруг длинной оси молекулы (α-спираль); эти кератины являются основой волос (включая шерсть), рогов, когтей и копыт млекопитающих.
- β-кератины, более твёрдые и имеющие форму несколько зигзагообразных полипептидных цепей (т. н. β-листы); эти кератины обнаружены в когтях и чешуе рептилий, в их панцирях ( у черепах), в перьях, клювах и когтях птиц, в иглах дикобразов.
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Вторичная структура РНК
Молекулы РНК представляют собой единичные полинуклеотидные цепи. Отдельные участки молекулы РНК могут соединяться и образовывать двойные спирали
Конформация – это пространственное расположение в органической молекуле замещающих групп, способных свободно изменять свое положение в пространстве без разрыва связей, благодаря свободному вращению вокруг одинарных углеродных связей.
Различают 2 вида вторичной структуры белка:
1.
α
-спираль
2.
β
-складчатость.
Вторичную структуру стабилизируют водородные связи. Водородные связи возникают между атомом водорода в NH группе и карбоксильным кислородом.
Характеристика
α
-спирали.
- α
-спираль стабилизируется водородными связями, которые возникают между каждой первой и четвертой аминокислотой. Шаг спирали включает 3, 6 аминокислотных остатка. - Образование
α
-спирали происходит по часовой стрелке (правый ход спирали), т. к. природные белки состоят из L-аминокислот.
Для каждого белка характерна своя степень спирализации полипептидной цепи. Спирализованные участки чередуются с линейными. В молекуле гемоглобина
α
и
β
-цепи спирализованы на 75%, в лизоциме – 42%, пепсине – 30%.
Степень спирализации зависит от первичной структуры белка.
- α
-спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии. - В образовании водородных связей участвуют все пептидные группы. Это обеспечивает максимальную стабильность
α
-спирали. - так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, то гидрофобность альфа спиралей увеличивается.
- радикалы аминокислот находятся на наружной стороне альфа спиралей и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, характерны для вторичной структуры, но некоторые из них могут нарушать формирование альфа спиралей:
- Пролин. Его атом азота входит в состав жесткого кольца, что исключает возможность вращения вокруг N-CH связей. Кроме того, у атома азота пролина, образующего связь с другой аминокислотой нет водорода. В результате пролин не способен организовать водородную связь и структура альфа спиралей нарушается. Обычно здесь возникает петля или изгиб.
- Участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания.
- Участки с близко расположенными обьемными радикалами, механически нарушающими формирование альфа спиралей, например метионин, триптофан.
Спирализации белковой молекулы препятствует аминокислота пролин.
β
— складчатость имеет слабоизогнутую конфигурацию полипептидной цепи.
Если связанные полипептидныые цепи направлены противоположно, возникает антипараллельная
β
-структура, если же N и С концы полипептидных цепей совпадают, возникает структура параллельного
β
-складчатого слоя.
Для
β
-складчатости характерны водородные связи в пределах одной полипептидной цепи или сложных полипептидных цепей.
В белках возможны переходы от
α
-спирали к
β
-складчатости и обратно вследствие перестройки водородных связей.
β
-складчатость имеет плоскую форму.
α
-спираль имеет стержневую форму.
Водородные связи – слабые связи, энергия связи 10 – 20 ккал/моль, но большое количество связей обеспечивает стабильность белковой молекулы.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Свойства белков
Примем во внимание два главных свойства:
- Денатурация — нарушение природной структуры белка при воздействии на него определенных факторов (высокой температуры, излучения, воздействия кислот, щелочей, солей). Обратимая денатурация называется ренатурацией — процесс обратим, если не разрушается первичная структура, являющаяся основной. При необратимой денатурации затрагивается первичная структура, которая восстановиться уже не может. В качестве примера такого процесса можно привести яйцо, которое на сковороде превращается в яичницу. В этом случае строение белка полностью нарушено и не восстановимо.
- Белки — органические растворители. Данные макромолекулы используются и как отличные растворители.
Обязательно стоит перейти к вопросу о классификациях белков. Разные биополимеры имеют разное строение, а также физические свойства.
Рис. 5. Четвертичная структура белка
Экспериментальное определение
Примерное содержание вторичной структуры биополимера (например, «этот белок представляет собой 40% α-спирали и 20% β-листа ») можно оценить спектроскопически . Для белков распространенным методом является круговой дихроизм в дальнем ультрафиолете (дальний УФ, 170–250 нм) . Ярко выраженный двойной минимум на 208 и 222 нм указывает на α-спиральную структуру, тогда как одиночный минимум на 204 нм или 217 нм отражает структуру случайных катушек или β-пластин, соответственно. Менее распространенным методом является инфракрасная спектроскопия , которая обнаруживает различия в колебаниях связей амидных групп из-за образования водородных связей. Наконец, содержание вторичной структуры может быть точно оценено с использованием химических сдвигов изначально неназначенного спектра ЯМР .
Третичная структура взаимодействия
Ниже приведены основные взаимодействия, которые составляют третичные структуры белков. Они управляют изгибом и скручиванием, которые помогают белковой молекуле достичь стабильного состояния. Мы можем наблюдать взаимодействия, которые являются ковалентными, где пары электронов распределяются между атомами, или нековалентными, когда пары электронов не распределяются между атомами. Напомним, что разрушение этих связей может привести к денатурации белка.
Гидрофобные взаимодействия
Эти нековалентные связи являются наиболее важным фактором и движущей силой в формировании третичной структуры.
Если мы разместим гидрофобный (ненавидящие воду) молекулы в воде, эти молекулы будут собираться вместе и образовывать большие куски гидрофобных молекул. Поскольку некоторые R-группы гидрофильный (любящий воду) и другие являются гидрофобными, все аминокислоты, содержащие гидрофильные боковые цепи, такие как изолейцин, будут обнаружены на поверхности белка, в то время как аминокислоты, которые имеют гидрофобные боковые цепи, такие как аланин, будут объединяться вместе в центре белка. Следовательно, белок, который образуется в воде, как и большинство из них, будет иметь гидрофобное ядро и гидрофильную поверхность
Это очень важно при определении того, как будет выглядеть третичная структура
Дисульфидные Мосты
Это очень сильные ковалентные связи, обнаруженные между остатками цистеина, которые находятся в непосредственной близости в космосе. Связи образуются между серными группами на различных остатках цистеина, как показано ниже.
Ионные облигации
Некоторые аминокислоты содержат боковые цепи, которые несут положительные или отрицательные заряды. Если аминокислота с положительным зарядом достаточно близка к аминокислоте, которая несет отрицательный заряд, они могут образовать связь, которая помогает стабилизировать молекулу белка.
Водородные связи
Мы можем наблюдать эти связи между молекулами воды в решение и гидрофильные аминокислотные боковые цепи на поверхности молекулы. Водородные связи также возникают между полярными боковыми цепями и помогают стабилизировать третичную структуру.
Структуры белков
Каждый белок в природе состоит из определенного количества структур, которые обусловливают сложность его строения. Они формируются в каналах эндоплазматической сети. С этими структурами сильно связаны и основные свойства белков — денатурация и ренатурация, которые мы рассмотрим позже.
Первичная структура
Данная структура определяет количество аминокислот в цепи пептидов. В молекуле возникают пептидные связи (рис.1).То есть эта структура представляет собой последовательность различных аминокислот, соединенных друг с другом пептидными связями.
Вторичная структура
Представляет собой альфа-спираль, которая прошита многочисленными водородными связями (рис.2).Еще данная структура может представлять собой бета-слой.Бета-слой (рис.3) — складчатая структура, состоящая из ряда параллельных полипептидных цепей, соединенных водородными связями. Является более прочным, чем альфа-спираль.
Рис. 3. Бета-слой
Третичная структура
Здесь полипептидная цепь компактно уложена в глобулу (рис.4).В глобулу могут входить ионные, водородные, дисульфидные связи. Между радикалами могут возникать гидрофобные и гидрофильные взаимодействия. Сюда же входят различные ферменты и антитела с глобулярным строением.
Рис. 4. Глобула
Четвертичная структура
Пожалуй, является наиболее сложной из всех. В ней несколько полипептидных цепей удерживаются в молекуле гидрофобными взаимодействиями и ионными связями (рис.5).Четыре глобулы соединены воедино. Данное строение имеет гемоглобин, чрезвычайно важный для человеческого организма.Теперь, после изучения основного строения белков, перейдем к краткому рассмотрению свойств этих биополимеров, которые вытекают из наличия всех указанных выше структур.